옥텟 규칙
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
옥텟 규칙은 원자들이 화학 결합을 형성할 때, 가장 바깥쪽 전자 껍질에 8개의 전자를 가지려는 경향을 설명하는 규칙이다. 1916년 길버트 N. 루이스와 발터 코셀에 의해 제안되었으며, 1919년 어빙 랭뮤어에 의해 "옥텟 이론"으로 발전했다. 옥텟 규칙은 주로 2주기 원소에 적용되며, 듀엣 규칙과 18전자 규칙 등 다른 규칙들도 존재한다. 옥텟 규칙은 전자를 얻거나 잃거나 공유하여 비활성 기체와 같은 전자 배치를 얻으려는 경향을 설명하며, 옥텟 규칙의 예외로 불완전한 팔전자계, 홀수 전자 분자, 확장된 옥텟 등이 있다.
더 읽어볼만한 페이지
- 경험 법칙 - 무어의 법칙
무어의 법칙은 집적회로의 성능이 일정 기간마다 두 배로 증가한다는 경험적 관찰로, 반도체 산업 발전을 이끄는 지표였으나, 최근 성장 둔화에도 불구하고 기술 혁신을 통해 성능 향상이 지속되며 기술 혁신 과정 자체를 의미하는 개념으로 진화하고 있다. - 경험 법칙 - 오른손 법칙
오른손 법칙은 3차원 공간에서 좌표축 방향, 회전 방향, 자기장 방향 등을 정의하는 규칙으로, 해밀턴이 처음 도입하고 기브스가 발전시켜 물리학, 공학 등에서 벡터 외적, 전자기학적 현상 설명에 활용된다. - 스핀트로닉스 - 파울리 배타 원리
파울리 배타 원리는 1925년 볼프강 파울리가 제시한 양자역학 원리로, 동일한 페르미온은 동일한 양자 상태에 존재할 수 없으며, 원자의 전자 배치, 화학 결합, 천체 특성 등을 설명하는 데 중요한 역할을 한다. - 스핀트로닉스 - 전자
전자는 음전하를 띤 기본 입자로서 원자의 구성 요소이며 파동-입자 이중성을 가지고 양자역학으로 설명되며 전자기력, 약한 힘과 상호 작용하여 전자 현미경, 자유전자레이저, 반도체 기술 등에 활용된다. - 물리화학 - 활성화 에너지
활성화 에너지는 화학 반응이 일어나기 위해 반응물이 넘어야 하는 최소 에너지 장벽으로, 반응 속도에 직접적인 영향을 미치며 촉매에 의해 조절될 수 있고, 아레니우스 식으로 표현되며, 다양한 화학 현상 이해에 필수적인 개념이다. - 물리화학 - 전해질
전해질은 용액에서 이온으로 해리되어 전기 전도성을 갖는 물질로, 생체 내에서 세포막 전위 유지 및 신경-근육 기능 조절에 필수적이며, 농도와 해리 정도에 따라 강전해질과 약전해질로 나뉜다.
2. 역사

1864년, 영국의 화학자 존 뉴랜즈는 알려진 62가지 원소들을 물리적 성질에 따라 8개의 그룹으로 분류했다.[4][5][6][7]
19세기 후반, 배위 화합물(이전에는 "분자 화합물"이라고 불림)은 원자나 분자가 결합하여 관련된 원자의 원자가가 명백히 만족되는 방식으로 형성된다는 것이 알려졌다. 1893년, 알프레드 베르너는 중심 원자와 관련된 원자 또는 그룹의 수("배위수")가 종종 4 또는 6임을 보였다. 최대 8까지의 다른 배위수가 알려져 있었지만 덜 빈번했다.[8]
1904년, 리하르트 아베크는 배위수 개념을 원자가 개념으로 확장하여, 전자를 주거나 받는 원자를 구분하여 현대의 산화 상태 개념과 매우 유사한 양의 원자가 상태와 음의 원자가 상태를 제시했다. 아베크는 최대 양의 원자가와 최대 음의 원자가의 차이가 8인 경우가 많다는 것을 발견했다.[9]
1916년, 길버트 N. 루이스는 아베크의 법칙을 이용해 입방 원자 모델과 "8의 법칙"을 공식화하고, 원자가와 원자가 전자를 구별하기 시작했다.[10] 1919년, 어빙 랭뮤어는 이 개념을 더욱 발전시켜 "입방 옥텟 원자"와 "옥텟 이론"으로 명명했다.[11] "옥텟 이론"은 현재 "옥텟 규칙"으로 알려져 있다.
발터 코셀[12]과 길버트 N. 루이스는 비활성 기체가 일반적인 조건에서 화학 반응에 참여하지 않는 경향이 있다는 것을 관찰하고, 비활성 기체 원자들이 안정적이라고 결론지었다. 이를 바탕으로 1916년 "전자 원자가 이론"으로 알려진 원자가 이론을 제안했다.
2. 1. 초기 연구
1864년, 영국의 화학자 존 뉴랜즈는 알려진 62가지 원소들을 물리적 성질에 따라 8개의 그룹으로 분류했다.[4][5][6][7]19세기 후반, 배위 화합물(이전에는 "분자 화합물")은 원자나 분자가 결합하여 원자가가 만족되는 방식으로 형성된다는 것이 알려졌다. 1893년, 알프레드 베르너는 중심 원자와 관련된 원자나 그룹의 수("배위수")가 주로 4 또는 6임을 보였다. 최대 8까지의 다른 배위수도 알려져 있었지만 덜 빈번했다.[8] 1904년, 리하르트 아베크는 배위수 개념을 원자가 개념으로 확장하여, 전자를 주거나 받는 원자를 구분하여 현대의 산화 상태와 유사한 양과 음의 원자가 상태를 제시했다. 아베크는 최대 양의 원자가와 최대 음의 원자가의 차이가 8인 경우가 많다는 것을 발견했다.[9] 1916년, 길버트 N. 루이스는 이 통찰력을 아베크의 법칙이라 부르고, 이를 그의 입방 원자 모델과 "8의 법칙"을 공식화하는 데 사용하여, 원자가와 원자가 전자를 구별하기 시작했다.[10] 1919년, 어빙 랭뮤어는 이 개념을 더욱 발전시켜 "입방 옥텟 원자"와 "옥텟 이론"으로 명명했다.[11] "옥텟 이론"은 현재 "옥텟 규칙"으로 알려지게 되었다.
발터 코셀[12]과 길버트 N. 루이스는 비활성 기체가 일반적인 조건에서 화학 반응에 참여하지 않는 경향이 있다는 것을 발견했다. 이를 바탕으로 그들은 비활성 기체 원자들이 안정적이라고 결론짓고, 1916년에 "전자 원자가 이론"이라는 원자가 이론을 제안했다.
1916년에 발터 코셀은 닐스 보어의 원자 모형을 바탕으로, 비활성 기체처럼 최외각 전자가 8개인 상태가 화학적으로 안정적이며, 원자는 이러한 전자 배치를 가지려고 이온화한다는 이론을 제시했다.
같은 해 길버트 N. 루이스는 코셀과는 별개로 최외각 전자가 원자핵을 중심으로 하는 정육면체의 8개 꼭짓점(옥텟)을 각각 차지하려 한다고 제안했다(1902년에 이미 이러한 생각을 보였다고 한다). 그는 그 꼭짓점에 있는 전자의 수로 원자의 화학적 성질이 결정되며, 주기율을 설명했다. 또한 코셀처럼 모든 꼭짓점에 전자가 있으면 비활성 기체처럼 원자가 화학적으로 안정적이라고 했다. 루이스는 더 나아가 이 이론으로 공유 결합을 설명했다. 단일 결합을 형성하려는 두 원자는 정육면체의 한 모서리를 공유하고, 양 끝 꼭짓점의 전자도 공유한다. 이중 결합은 한 면을 공유하고, 꼭짓점의 4개 전자를 공유한다. 이로써 메테인의 정사면체 구조를 설명할 수 있다. 한편, 이 이론에서는 삼중 결합의 결합 설명이 어렵고, 단일 결합이 자유롭게 회전할 수 없다는 점도 언급했다. 옥텟 규칙은 보어의 원자 모형에서 전자가 원운동을 한다는 가정과 모순되어, 루이스는 보어의 생각에 비판적이었다.
1919년에 어빙 랭뮤어는 루이스의 생각을 바탕으로 사면체형 대칭성을 가진 새로운 원자 모형을 제시했다.
루이스의 정육면체형 전자 배치나 랭뮤어의 사면체 대칭 원자는 파울리의 배타 원리를 바탕으로 다양한 화학 결합을 간단하고 모순 없이 설명할 수 있다. 20세기에 발전한 양자역학의 상세한 이해와는 대조적으로 직관적인 이해를 돕는다. 그 결과, 직관적인 화학 결합 이론은 전자의 혼성 궤도 함수나 양자역학을 이용한 분자 궤도 함수 등의 이론적 처리에도 포함되어 있다.
2. 2. 옥텟 규칙의 정립
1864년, 영국의 화학자 존 뉴랜즈는 알려진 62가지 원소들을 물리적 성질에 따라 8개의 그룹으로 분류했다.[4][5][6][7]19세기 후반에는 원자나 분자가 결합하여 원자가가 만족되는 방식으로 배위 화합물이 형성된다는 것이 알려졌다. 1893년, 알프레드 베르너는 중심 원자와 관련된 원자 또는 그룹의 수(배위수)가 종종 4 또는 6임을 보였다. 최대 8까지의 다른 배위수도 알려져 있었지만 덜 빈번했다.[8] 1904년, 리하르트 아베크는 배위수 개념을 원자가 개념으로 확장하여, 전자를 주거나 받는 원자를 구분하여 현대의 산화 상태 개념과 유사한 양과 음의 원자가 상태를 제시했다. 아베크는 최대 양의 원자가와 최대 음의 원자가의 차이가 8인 경우가 많다는 것을 발견했다.[9] 1916년, 길버트 N. 루이스는 이 통찰력을 아베크의 법칙이라고 언급하고, 이를 입방 원자 모델과 "8의 법칙"을 공식화하는 데 사용했으며, 원자가와 원자가 전자를 구별하기 시작했다.[10] 1919년, 어빙 랭뮤어는 이러한 개념을 개선하여 "입방 옥텟 원자"와 "옥텟 이론"으로 이름을 바꾸었다.[11] "옥텟 이론"은 현재 "옥텟 규칙"으로 알려지게 되었다.
발터 코셀[12]과 길버트 N. 루이스는 비활성 기체가 일반적인 조건에서 화학 반응에 참여하는 경향이 없다는 것을 바탕으로, 비활성 기체 원자들이 안정적이라고 결론짓고 1916년 "전자 원자가 이론"을 제안했다.[13]
1916년에 발터 코셀은 닐스 보어의 원자 모형을 바탕으로, 비활성 기체 원자처럼 최외각 전자가 8개인 상태가 화학적으로 안정적이며, 원자는 이러한 전자 배치를 가지려고 이온화한다는 이론을 제시했다.
같은 해 길버트 N. 루이스는 코셀과는 독립적으로 최외각 전자가 원자핵을 중심으로 하는 정육면체의 8개 꼭짓점(옥텟)을 각각 차지하려 한다고 제안했다. 그리고 그 꼭짓점에 있는 전자의 수로 원자의 화학적 성질이 결정되며, 주기율을 설명했다. 또한 코셀과 마찬가지로 모든 꼭짓점에 전자가 있는 경우 비활성 기체 원자와 마찬가지로 원자는 화학적으로 안정적이라고 했다. 루이스는 더 나아가 이 이론을 이용하여 공유 결합을 설명했다. 단일 결합을 만들려는 두 원자는 정육면체의 한 모서리를 공유하고, 그 양 끝 꼭짓점에 있는 전자도 공유한다. 이중 결합의 경우에는 한 면을 공유하고, 그 꼭짓점의 4개 전자를 공유한다. 이와 같이 메테인의 정사면체 구조를 설명하는 것도 가능하다. 한편 이 이론에서는 삼중 결합의 결합 설명이 어렵다는 점이나 단일 결합이 자유롭게 회전할 수 있다는 점을 설명할 수 없다는 점도 언급하고 있다. 옥텟 규칙은 보어의 원자 모형에서 전자가 원운동을 한다는 가정과 모순되며, 루이스는 이 때문에 보어의 생각에 비판적이었다.
1919년에 어빙 랭뮤어는 루이스의 생각을 바탕으로 사면체형의 대칭성을 가진 새로운 원자 모형을 제시했다.
루이스가 생각한 정육면체형 전자 배치나 랭뮤어가 생각한 사면체 대칭 원자는 파울리의 배타 원리를 바탕으로 다양한 화학 결합을 간단하고 모순 없이 설명할 수 있다. 20세기에 발전한 양자역학의 상세한 이해와는 대조적으로 직관적인 이해를 할 수 있다. 그 결과, 직관적인 화학 결합 이론은 전자의 혼성 궤도 함수나 양자역학을 이용한 분자 궤도 함수 등의 이론적 처리에도 포함되어 있다.
2. 3. 현대적 이해
1916년에 발터 코셀은 닐스 보어의 원자 모형을 바탕으로, 비활성 기체 원자와 같이 최외각 전자가 8개인 상태가 화학적으로 안정적이며, 원자는 이러한 전자 배치를 가지려고 이온화한다는 이론을 제시했다.[1]같은 해 길버트 N. 루이스는 코셀과는 독립적으로 최외각 전자가 원자핵을 중심으로 하는 정육면체의 8개 꼭짓점(옥텟(octet) 또는 팔우자(八隅子))을 각각 차지하려 한다고 제안했다 (실제로는 1902년에 이미 이러한 생각을 보였다고 한다). 그리고 그 꼭짓점에 있는 전자의 수로 원자의 화학적 성질이 결정되며, 주기율을 설명했다. 또한 코셀과 마찬가지로 모든 꼭짓점에 전자가 있는 경우 비활성 기체 원자와 마찬가지로 원자는 화학적으로 안정적이라고 했다. 더 나아가 루이스는 이 이론을 이용하여 공유 결합을 설명했다. 단일 결합을 만들려는 두 원자는 정육면체의 한 모서리를 공유하고, 그 양 끝 꼭짓점에 있는 전자도 공유한다. 이중 결합의 경우에는 한 면을 공유하고, 그 꼭짓점의 4개 전자를 공유한다. 이와 같이 메테인의 정사면체 구조를 설명하는 것도 가능하다. 한편 이 이론에서는 삼중 결합의 결합 설명이 어렵다는 점이나 단일 결합이 자유롭게 회전할 수 있다는 점을 설명할 수 없다는 점도 언급하고 있다. 옥텟 규칙은 보어의 원자 모형에서 전자가 원운동을 한다는 가정과 모순되며, 루이스는 이 때문에 보어의 생각에 비판적이었다.[1]
1919년에 어빙 랭뮤어는 루이스의 생각을 바탕으로 사면체형의 대칭성을 가진 새로운 원자 모형을 제시했다.[1]
루이스가 생각한 정육면체형 전자 배치나 랭뮤어가 생각한 사면체 대칭 원자는 파울리의 배타 원리를 바탕으로 다양한 화학 결합을 간단하고 모순 없이 설명할 수 있다. 20세기에 발전한 양자역학의 상세한 이해와는 대조적으로 직관적인 이해를 할 수 있다. 그 결과, 직관적인 화학 결합 이론은 전자의 혼성 궤도 함수나 양자역학을 이용한 분자 궤도 함수 등의 이론적 처리에도 포함되어 있다.[1]
3. 원자가 전자를 이용한 표현
원자가 전자는 바닥상태에서 반응에 참여할 수 있는 전자의 수이다. 18족 원소를 제외한 나머지 족에 해당하는 원소는 원자가 전자 수와 최외각 전자 수가 같다. 18족 원소는 비활성 기체라고 불리며, 다른 물질과 반응하지 않으므로 원자가 전자의 수가 0이다. 옥텟 규칙의 목적은 이러한 비활성 기체의 최외각 전자 수를 만족함으로써 원자가 다른 원소와 잘 반응하지 않는 비활성 기체의 성질을 만족하는 것이다.
옥텟 규칙을 만족하는 원자들은 주위에서 쉽게 찾을 수 있는데, 대표적인 예시가 산소와 질소이다. 일상생활에서 부르는 산소와 질소는 원자 단독 형태가 아니라 원자 두 개가 공유결합을 하는 형태로 존재한다. 이때 공유결합이 각 원자에서 옥텟 규칙을 만족하게 만들어 두 원자가 안정한 분자 상태로 존재하게 된다. O2, N2가 이에 해당한다.
4. 듀엣 규칙
공유 결합 상태의 수소나 1주기 금속 원소들은 헬륨과 같이 최외각 전자 수를 2개로 맞추는 듀엣 규칙(duet rule)을 따른다. 따라서 H가 단독으로 있을 때보다 H-H (H2) 결합을 한 상태가 안정하므로 자연계의 수소 대부분은 이 상태로 존재한다.
5. 양자 이론에서의 설명
양자론에 따르면, 원자의 옥텟 규칙은 8개의 전자를 s2p6 전자 배치를 가진 닫힌 껍질로 설명한다. 닫힌 껍질 배치란 낮은 에너지 준위가 모두 채워지고 높은 에너지 준위는 비어 있는 상태를 말한다. 예를 들어, 네온 원자의 바닥 상태는 가득 찬 껍질(2s2 2p6)과 비어 있는 껍질을 가지고 있다. 옥텟 규칙에 따르면, 주기율표에서 네온 바로 앞과 뒤에 있는 원자들(즉, C, N, O, F, Na, Mg, Al)은 전자를 얻거나 잃거나 공유하여 이와 유사한 배치를 얻는 경향이 있다.
아르곤 원자는 유사한 3s2 3p6 배치를 가지고 있다. 비어 있는 3d 준위도 있지만, (수소 원자와 달리) 3s와 3p보다 에너지가 훨씬 높기 때문에, 화학적 목적으로는 3s2 3p6이 여전히 닫힌 껍질로 간주된다. 아르곤 바로 앞과 뒤에 있는 원자들은 화합물에서 이러한 배치를 얻는 경향이 있다. 그러나 3d 준위가 결합에 어느 정도 관여할 수 있는 일부 초원자가 분자들이 있지만, 이는 논란의 여지가 있다.
헬륨의 경우, 양자론에 따르면 1p 준위가 없으므로, 1s2는 p 전자가 없는 닫힌 껍질이다. 헬륨 앞뒤에 있는 원자(H와 Li)는 이중항 규칙을 따르며 헬륨과 같은 1s2 배치를 갖는 경향이 있다.
6. 예외
옥텟 규칙은 주로 2주기 원소에 적용되지만, 몇 가지 예외가 존재한다. 이러한 예외는 크게 세 가지로 나눌 수 있다.
- 불완전한 팔전자계: 중심 원자 주위에 전자가 8개보다 적은 경우이다. 베릴륨(Be) 화합물(BeH2)은 베릴륨 주위에 전자가 4개, 삼플루오린화 붕소(BF3)는 붕소 주위에 전자가 6개만 존재한다.
- 홀수 전자 분자: 일산화 질소(NO)와 같이 전자가 홀수 개인 분자는 옥텟 규칙을 만족시키기 어렵다. 이러한 분자를 라디칼이라 부르며, 반응성이 매우 크다.
- 확장된 옥텟 (초원자가 분자): 3주기 이상의 원소는 8개보다 많은 전자를 가질 수 있다. 오염화 인(PF₅)이나 육플루오린화 황(SF₆) 등이 그 예이다. 라이너스 폴링은 초기 양자 역학에서 3주기 원소가 하나의 s 오비탈, 세 개의 p 오비탈, 하나의 d 오비탈을 사용하여 5개 또는 6개의 결합을 형성할 수 있다고 제안했다.[17][18]
일산화 질소(NO)와 같은 일부 안정적인 분자 라디칼은 삼전자 결합을 통해 옥텟 규칙을 만족하기도 한다.[14]
6. 1. 불완전한 팔전자계
어떤 화합물에서는 중심 원자 주위의 전자 수가 8개보다 적어도 그 분자가 안정될 때가 있다. 가령 2주기 원소이며 알칼리 토금속인 베릴륨(Be)을 생각해보자. 베릴륨은 2s 궤도에 원자가 전자가 2개 있다. 기체 상태에서 BeH2는 분자로 존재하므로 H-Be-H라는 루이스 구조식으로 나타낼 수 있고, 이 구조식에서 알 수 있듯이, Be는 4개의 전자만으로 둘러싸여 있다. 다른 예시로 삼플루오린화 붕소(BF3)도 붕소의 전자 수가 6개이므로 옥텟 규칙에 어긋난다.많은 반응성 중간체는 불안정하며 옥텟 규칙을 따르지 않는다. 여기에는 카르벤과 같은 종뿐만 아니라 자유 라디칼(예: 탄소 원자의 비결합 궤도에 짝짓지 않은 전자를 가지고 있으며 같은 궤도에 반대 스핀의 전자가 없는 메틸 라디칼(CH3))도 포함된다. 또 다른 예로는 오존층 파괴에 관여하는 라디칼 일산화염소(ClO•)가 있다. 이러한 분자들은 종종 옥텟을 완성하기 위해 반응한다. 전자 부족 분자인 보란도 옥텟 규칙을 따르지 않지만 금속 결합과 유사한 방식으로 비편재화된 전자를 공유한다.
안정적인 홀전자 분자와 초원자가 분자는 일반적으로 옥텟 규칙을 위반하는 것으로 가르치지만, *ab initio* 분자 궤도 함수 계산에 따르면 이들은 대부분 옥텟 규칙을 따른다.
6. 2. 홀수 전자 분자
일산화 질소(NO)는 질소가 옥텟 규칙을 위반하고 있어 불안정하다. 이때 일산화 질소는 좀 더 안정한 구조인 이산화 질소(NO2)로 바뀌려 하는데, 일산화 질소(NO)는 대기 중의 산소(O2)에서 산소 원자 하나와 추가적으로 결합하면서 이산화 질소가 된다. 이렇게 만들어진 이산화 질소도 최외각 전자가 7개로 일산화 질소와 마찬가지로 옥텟 규칙을 만족하지 못한다. 이러한 홀수 전자 분자를[29]라디칼이라고 한다.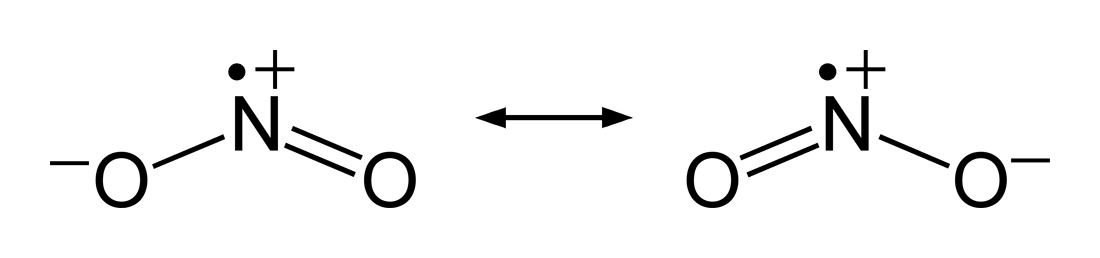
많은 반응성 중간체는 불안정하며 옥텟 규칙을 따르지 않는다. 여기에는 카르벤과 같은 종뿐만 아니라 자유 라디칼(예: 탄소 원자의 비결합 궤도에 짝짓지 않은 전자를 가지고 있으며 같은 궤도에 반대 스핀의 전자가 없는 메틸 라디칼(CH3))도 포함된다. 또 다른 예로는 오존층 파괴에 관여하는 라디칼 일산화 염소(ClO•)가 있다. 이러한 분자들은 종종 옥텟을 완성하기 위해 반응한다. 전자 부족 분자인 보란도 옥텟 규칙을 따르지 않지만 금속 결합과 유사한 방식으로 비편재화된 전자를 공유한다.
6. 3. 확장된 옥텟 (초원자가 분자)
옥텟 규칙은 일반적인 경우 극히 제한적으로 쓰이지만, 확장된 의미로 사용되는 경우가 많다. 확장된 옥텟 규칙은 주로 3주기 이상의 원소에 적용되며, 황산이나 오염화 인과 같이 중심 원자의 최외각 전자가 8개를 초과하는 분자들이 그 예시이다.2주기 원소는 결합 시 8개보다 많은 전자를 가질 수 없지만, 3주기 이상의 원소는 중심 원자 주위에 8개보다 많은 전자를 가질 수 있다. 3주기 원소는 3s, 3p 궤도함수 외에 3d 궤도함수도 결합에 이용할 수 있기 때문이다. 예를 들어, 육플루오린화 황(SF₆)에서 황(S)은 6개의 플루오린(F) 원자와 각각 공유 결합을 형성하여 총 12개의 전자를 갖는다.
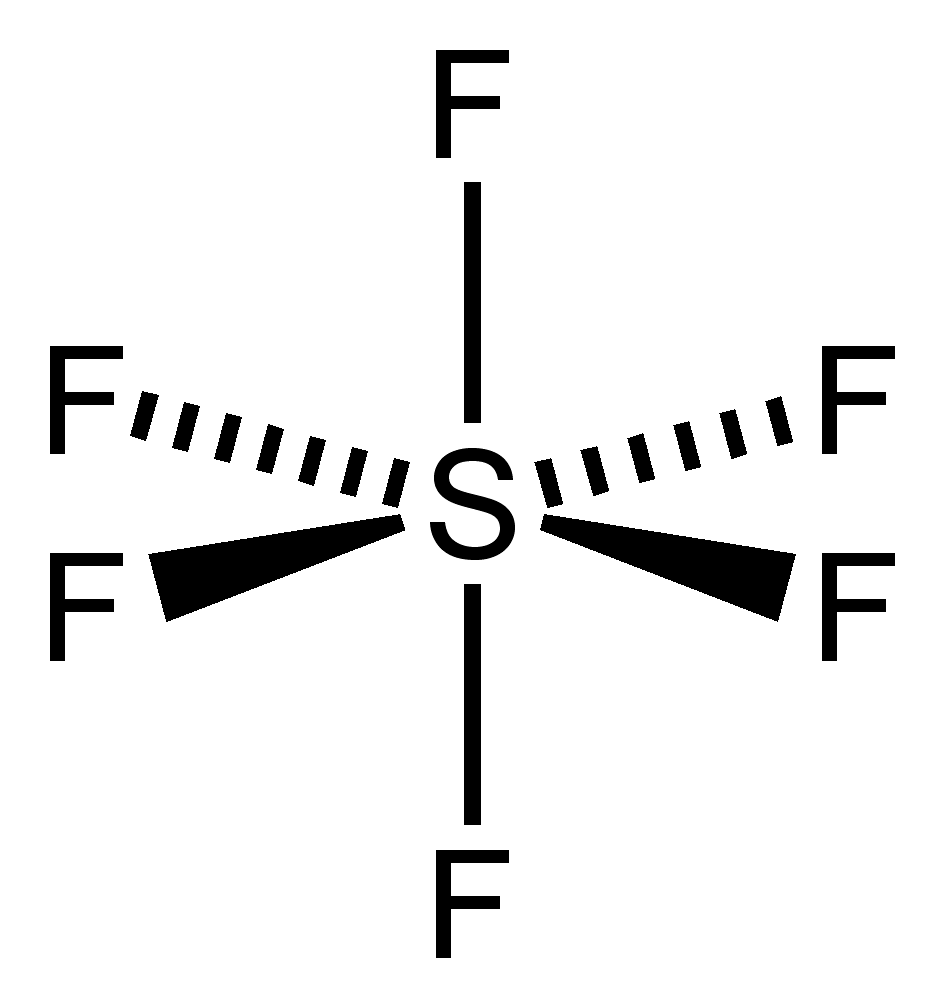
3주기 이후의 주족 원소들은 초원자가 분자를 형성할 수 있다. 예를 들어, 오플루오르화 인(PF₅)과 육플루오르화 황(SF₆)이 있다. 라이너스 폴링은 초기 양자 역학에서 3주기 원소가 하나의 s 오비탈, 세 개의 p 오비탈, 그리고 하나의 d 오비탈을 사용하여 5개의 결합을 형성하거나, 두 개의 d 오비탈을 추가하여 6개의 결합을 형성할 수 있다고 제안했다.[17] 5개의 결합은 5개의 sp³d 혼성 오비탈을 통해 10개의 공유 전자를, 6개의 결합은 6개의 sp³d² 혼성 오비탈을 통해 12개의 공유 전자를 갖게 된다.[18]
thumb
그러나 다른 모델들은 옥텟 규칙에 따라 s 오비탈과 p 오비탈만을 사용하여 결합을 설명한다. 원자가 결합 이론에서는 PF₅의 공명 구조를 통해 각 F가 4개의 구조에서는 공유 결합으로, 하나의 구조에서는 이온 결합으로 결합되어 P에 8개의 원자가 전자를 갖는다고 설명한다.[20] 분자 궤도 함수 이론에서는 최고 점유 분자 궤도 함수를 4개의 점유 결합 궤도 함수 외에 5개의 플루오린 원자에 국한된 비결합 궤도 함수로 간주하여, 인에 8개의 원자가 전자만 있다고 설명한다. 이론 계산에 따르면 결합 궤도 함수에 대한 d 함수의 기여는 작은 것으로 나타났다.[21][22]
역사적인 이유로, P, S, Se, I와 같은 원소 주위에 8개 이상의 전자를 나타내는 구조가 여전히 사용되지만, 이는 d 껍질 확장의 중요성이 없음에도 불구하고 IUPAC에서 권장하는 편리한 형식이다. 반면, Be, B, C, N, O, F 주위에 8개 이상, H, He, Li 주위에 2개 이상의 전자를 나타내는 것은 오류로 간주된다.
6. 4. 삼전자 결합

일산화 질소(NO)와 같이 일부 안정적인 분자 라디칼은 각 결합 원자의 옥텟에 공유 전자 하나와 비공유 전자 하나를 기여하는 삼전자 결합을 통해 옥텟 규칙을 만족한다.[14] NO에서 각 원자의 옥텟은 삼전자 결합의 두 전자, 두 개의 이전자 결합의 네 전자, 그리고 그 원자에만 있는 비결합 전자의 고립 전자쌍 두 전자로 구성된다. 이중 결합은 결합으로 계산되고 삼전자 결합은 공유 전자 하나만 있으므로 반 결합에 해당하므로 결합 차수는 2.5이다.
산소(O₂)는 때때로 두 쌍의 공유 전자를 포함하는 이중 결합(O=O)을 통해 옥텟 규칙을 따르는 것으로 표현된다.[15] 그러나 이 분자의 바닥 상태는 상자기성을 나타내며, 짝짓지 않은 전자의 존재를 나타낸다. 폴링은 이 분자가 실제로 두 개의 삼전자 결합과 하나의 일반적인 공유(이전자) 결합을 포함한다고 제안했다.[16] 그러면 각 원자의 옥텟은 각 삼전자 결합의 두 전자, 공유 결합의 두 전자, 그리고 비결합 전자의 고립 전자쌍 하나로 구성된다. 결합 차수는 1+0.5+0.5=2이다.

7. 이온 결합의 예시: 염화나트륨(NaCl)
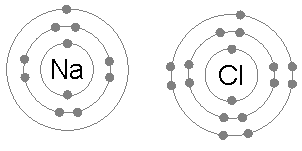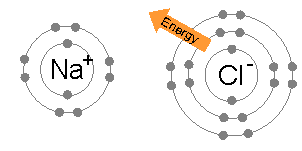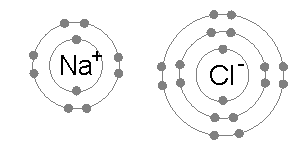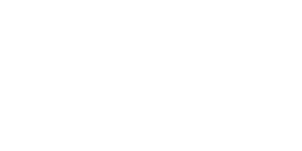
이온 결합은 보통 낮은 전기 음성도를 가진 금속(예: 나트륨) 원자와 높은 전기 음성도를 가진 비금속(예: 염소) 원자 사이에서 자주 발생한다.
염소 원자는 가장 바깥쪽(세 번째) 전자 껍질에 7개의 전자를 가지고 있으며, 첫 번째와 두 번째 껍질에는 각각 2개와 8개의 전자가 채워져 있다. 염소의 첫 번째 전자 친화도(염소가 전자를 얻어 Cl−를 형성할 때 방출되는 에너지)는 염소 원자 1몰당 349 kJ이다.[1] 가상의 Cl2-를 만들기 위해 두 번째 전자를 추가하려면 에너지가 필요한데, 이 에너지는 화학 결합을 만들 때 회수할 수 없다. 그 결과 염소는 Cl−에서처럼 가장 바깥쪽 껍질에 8개의 전자(완전한 옥텟)를 갖는 화합물을 주로 만든다.
나트륨 원자는 가장 바깥쪽 전자 껍질에 1개의 전자를 가지고 있으며, 첫 번째와 두 번째 껍질에는 각각 2개와 8개의 전자가 채워져 있다. 이 바깥쪽 전자를 제거하는 데는 첫 번째 이온화 에너지(+495.8 kJ/몰)만 필요하며, 이는 적은 양의 에너지이다. 반면, 두 번째 전자는 더 깊은 두 번째 전자 껍질에 있기 때문에 두 번째 전자를 제거하는 데 필요한 두 번째 이온화 에너지는 훨씬 더 크다(+4562 kJ/몰).[2] 따라서 나트륨은 대부분 단일 전자를 잃고 8개의 전자로 채워진 바깥쪽 껍질, 즉 옥텟을 갖는 화합물을 만든다.
나트륨 원자에서 염소 원자로 전자를 전달하는 데 필요한 에너지(나트륨의 첫 번째 이온화 에너지와 염소의 전자 친화도의 차이)는 +147 kJ mol−1로 적다. 이 에너지는 염화나트륨의 격자 에너지(−783 kJ mol−1)에 의해 쉽게 상쇄된다.[3] 이것으로 이 경우 옥텟 규칙에 대한 설명이 끝난다.
8. 다른 규칙
(주족 원소)
(전이 금속)